近日,我室赵宗保研究员团队和我所薛松研究员团队合作,在非天然辅酶研究方面取得新进展,获得了系列偏好非天然辅酶的亚磷酸脱氢酶突变体,解析了它们与非天然辅酶复合物的结构,揭示了辅酶偏好性改变的分子机制。相关研究成果发表在ACS Catalysis上。
天然辅酶,例如吡啶核苷酸辅酶NAD(P)不仅是氧化还原酶广泛使用的辅酶,还承担其它重要生物学功能。因此,天然辅酶扰动可以产生全局性的但同时也难以预测的生物学效应。为实现选择性调控辅酶关联的代谢反应,赵宗保研究团队提出了基于非天然辅酶的研究策略。前期工作中,该团队设计合成了系列非天然辅酶,如烟酰胺胞嘧啶二核苷酸(NCD),采用定向进化策略,筛选得到了多种偏好非天然辅酶的氧化还原酶突变体,并创建了正交的氧化还原催化体系(J. Am. Chem. Soc., 2011)。科研人员设计基于NCD和亚磷酸脱氢酶突变体的能量供给模块,成功用于对胞内代谢途径的选择性驱动,突破了内源代谢网络的热力学瓶颈(ACS Catal., 2017)。
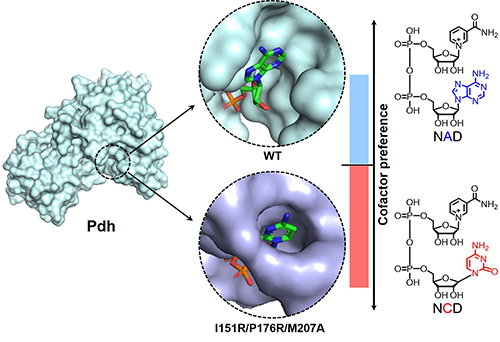
该研究中科研人员成功改造并获得NCD偏好性显著改善的亚磷酸脱氢酶突变体,突变酶几乎不利用天然辅酶NAD,但底物亲和力得以保持;获得了亚磷酸脱氢酶野生型和两种突变体的晶体结构,以及其酶-NCD复合体结构。研究发现突变引入的氨基酸残基,一方面造成辅酶结合空腔收缩,限制了NAD进入,另一方面为NCD结合提供了新的分子间相互作用,从而导致突变体显著偏好NCD。该研究成果将为理性改造其它氧化还原酶提供重要科学参考,并促进开展基于非天然辅酶的合成生物学和化学生物学研究。
以上研究得到了国家自然科学基金、大连化物所-青岛能源所融合基金等项目的资助。同时,这也是献礼我所七十周年所庆文章之一。(文/图 刘玉雪 冯延宾)